De nouvelles structures identifiées au sein de nos chromosomes
Depuis le début de ce siècle, de grandes avancées technologiques au niveau moléculaire et génomique, couplées à de nouvelles approches en microscopie photonique à très haute résolution, ont permis de révéler des nouvelles structures chromosomiques et des nouveaux principes d’organisation de nos génomes (le génome contient l’ensemble de l’information génétique et donc l’ensemble des séquences d’ADN transmises au travers des divisions cellulaires).
Frédéric Bantignies, Université de Montpellier et Giacomo Cavalli, Université de Montpellier
Ces connaissances sont cruciales à la compréhension du fonctionnement de nos cellules, mais également pour mieux comprendre certaines maladies et leur évolution.
L’acide désoxyribonucléique, ou ADN, renferme l’information génétique spécifique à chaque espèce vivante. Les chromosomes représentent les supports physiques de cette information. L’ensemble des chromosomes est aussi appelé génome et contient l’ensemble des gènes. Depuis la découverte en 1953 de la structure en double hélice de l’ADN, la question de son organisation au sein des noyaux de nos cellules a suscité de nombreuses recherches mondiales. Pour bien appréhender cette question, on peut repréciser ici que l’homme possède 46 chromosomes, lesquels renferment 3 milliards de paires de bases (pb) d’ADN, ce qui représente un filament moléculaire d’environ 2 m. Or, ce filament est capable d’être contenu dans des noyaux cellulaires d’environ 10 μm (un micromètre = un millième de millimètre) de diamètre. Pour mieux comprendre le fonctionnement du génome et de nos gènes, il était donc indispensable de connaître comment tout cet ADN est capable de se replier dans un noyau cellulaire.
Au début de cette organisation, on a le nucléosome, dont la structure a été élucidée en 1997. Le nucléosome est formé de protéines très basiques appelées histones, qui ont une grande affinité pour la molécule acide de l’ADN. Ces histones vont former un corps central autour duquel la molécule d’ADN va s’enrouler, à raison de 146 pb pour un nucléosome, sorte de « macaron » de 11 nm (un nanomètre = un millionième de millimètre) de large et 6 nm de haut. Le nucléosome représente donc un premier niveau structurel de l’organisation de l’ADN dans les noyaux. Signe de son importance, cette structure très particulière est retrouvée chez tous les organismes à noyaux (les eucaryotes), qu’ils soient unicellulaires ou plus complexes comme chez les animaux et les plantes.
Très longtemps, on a pensé que la succession de nucléosomes (aussi appelée fibre de chromatine), formant une sorte de « collier de perles », s’enroulait à son tour de manière régulière pour former une fibre de 30 nm de diamètre. Des super-enroulements en spirales de cette fibre auraient finalement conduit aux chromosomes. Cependant, des limitations techniques, notamment la trop faible résolution des techniques de microscopie et l’absence d’autres méthodes, ne permettaient pas de démontrer si cette hypothèse était correcte.
D’autre part, on sait depuis 1985 que l’organisation des chromosomes dans les noyaux cellulaires n’est pas aléatoire. En outre, la forme bien connue des chromosomes en X n’est pas fausse, mais ne représente qu’une étape très transitoire de leur organisation. En effet, cette conformation en X très condensé est propice à leur ségrégation (leur partage) dans les cellules filles lors de la division cellulaire. Mais le reste du temps, la forme des chromosomes est tout autre. Leur visualisation grâce à des molécules fluorescentes capables de s’imbriquer spécifiquement dans la double hélice d’ADN a permis de montrer que chaque chromosome occupait son propre territoire à l’intérieur du noyau, évitant ainsi un trop fort enchevêtrement avec les autres chromosomes. Cette propriété de « territoire chromosomique » est également retrouvée chez la plupart des espèces et semble très importante, en particulier pour les espèces qui possèdent un grand nombre de chromosomes.
Les nouvelles technologies apportent un regard nouveau sur l’organisation du génome
Au début du 21e siècle, de nombreuses recherches à travers le monde ont permis de mieux comprendre les différents niveaux de l’organisation structurale du génome entre le nucléosome et les territoires chromosomiques.
Ces avancées ont été rendues possibles grâce au développement et à l’utilisation de toutes nouvelles technologies. Tout d’abord, il y eut des nouvelles techniques de génomique, incluant le séquençage de l’ADN à très haut débit (séquençage de nouvelle génération) et la possibilité de capturer moléculairement des structures fines des chromosomes grâce à la méthode « Hi-C ». En parallèle, l’arrivée de la microscopie photonique à super-résolution, qui utilise des marqueurs fluorescents de l’ADN, a permis d’aller visualiser ces structures chromosomiques directement dans le noyau des cellules.

Frédéric Bantignies, Giacomo Cavalli, Fourni par l’auteur
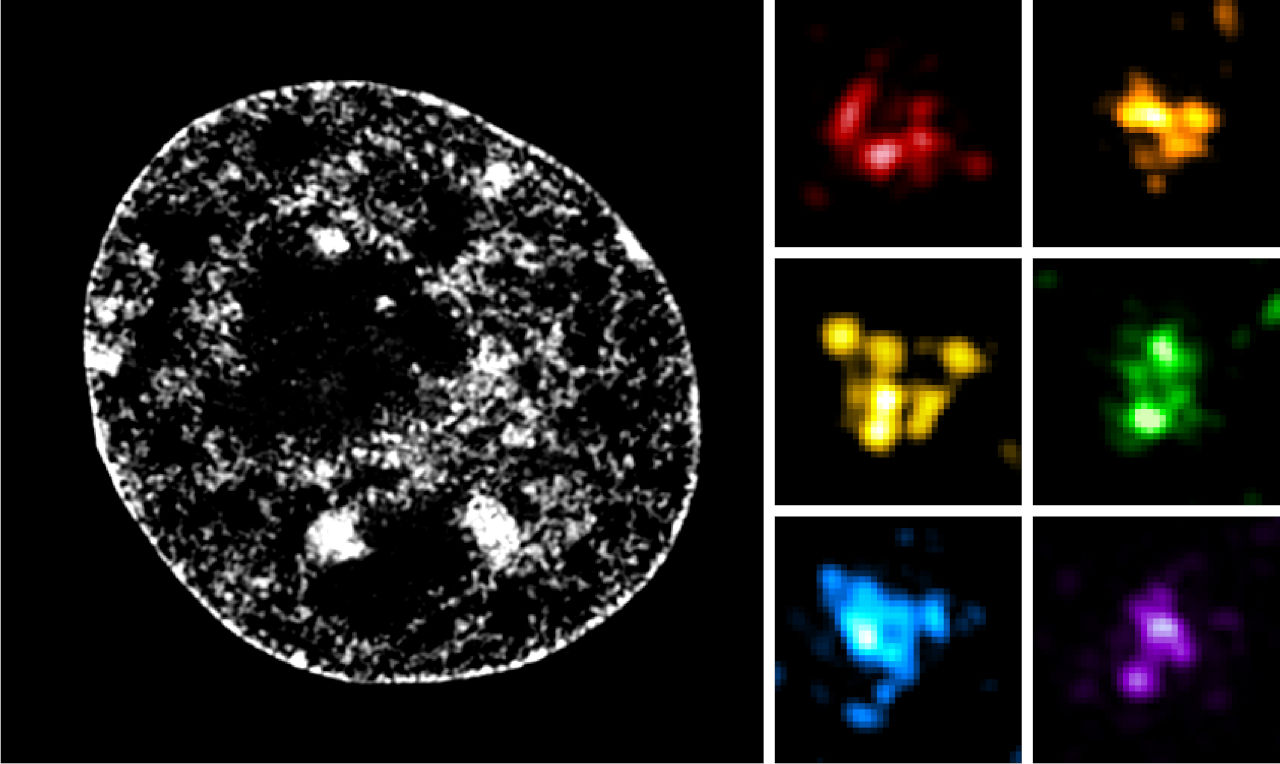
Revenons donc à notre échelle d’organisation des chromosomes. Son premier échelon est le nucléosome. Un deuxième niveau d’organisation va correspondre à des groupements de quelques nucléosomes, comme des petits amas que l’on appelle en anglais « nucleosome clutches » (ils ont été ainsi nommés par les auteurs de leur découverte en analogie aux œufs trouvés dans les nids couvés). Les nucléosomes ne sont donc pas groupés de manière régulière comme on le pensait, mais plutôt en paquets irréguliers.
Ces « nucleosome clutches » se groupent ensuite pour former une structure appelée « Chromatin Nanodomain », ou CND, qui inclue approximativement 100 000 à 200 000 paires de base d’ADN, formant des gros amas irréguliers de nucléosomes de 150 à 300 nm de large. Ces deux niveaux ont été découverts récemment (respectivement en 2015 et 2020), grâce à la microscopie en super-résolution, capable de résoudre des structures de 20 à 100 nm.
Les TADs structurent le génome et régulent l’expression des gènes
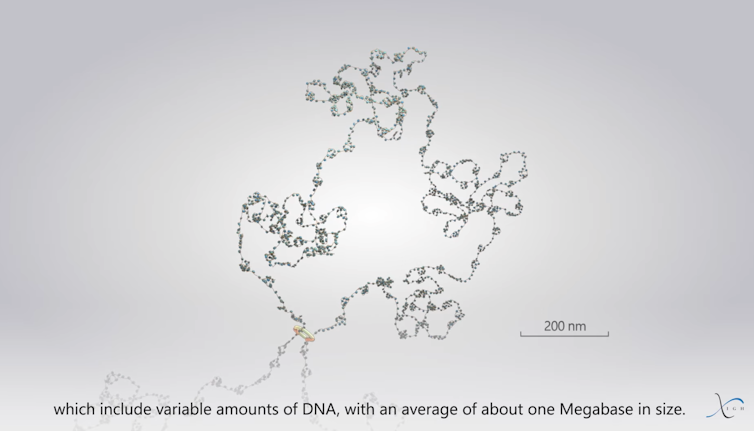
Le niveau suivant de cette organisation est appelé TAD, en anglais « Topologically Associating Domain » pour « domaine d’association topologique », identifiés en 2012 avec la méthode moléculaire du Hi-C. Les TADs sont composés de plusieurs CNDs, formant des super amas de nucléosomes d’environ 500 nm de large. Ils comprennent ainsi des tailles variables d’ADN, avec une moyenne d’environ 1 mégabase (1 million de paires de bases). Notre laboratoire a d’ailleurs contribué à la découverte des CNDs et des TADs.
Frédéric Bantignies, Giacomo Cavalli, Fourni par l’auteur
Les TADs sont des structures assez hétérogènes, notamment à cause de leur mécanisme dynamique de formation. Ce mécanisme implique le passage du fameux « collier de perles » (en référence à la succession de nucléosomes) à travers l’anneau que forme la cohésine. La fibre de chromatine va continuer à passer à travers l’anneau jusqu’à rencontrer aux frontières d’un TAD des facteurs nucléaires appelés CTCF, sorte de « douaniers » qui, postés sur l’ADN, vont bloquer la progression de la fibre. Au fur et à mesure du passage de la fibre, les nucléosomes s’organiseront en clutches et CNDs. Le TAD représente alors l’ensemble de cette large boucle de chromatine qui est passé à travers l’anneau de cohésine.
Au sein des chromosomes, l’activité des gènes est influencée par tout un tas de séquences régulatrices (sortes d’interrupteurs) qui peuvent se situer à des dizaines de milliers de paires de bases de distance de leur gène. Ainsi, les TADs vont préserver les gènes et leurs régions régulatrices dans un même environnement moléculaire, ce qui peut être propice à leur expression (c’est-à-dire leur lecture pour conduire à la production d’une protéine) dans un type cellulaire donné où leur activité est nécessaire. Grâce à leurs frontières, ils vont également permettre de bien séparer les gènes entre eux, pour éviter que des gènes actifs influencent d’autres gènes inactifs dans un type cellulaire donné.
Des études récentes ont montré que des défauts chromosomiques au niveau des frontières des TADs (du type inversion ou délétion impactant le positionnement de CTCF ou le rendant inopérant) entraînaient des défauts d’isolement entre les gènes, et donc des activations erronées de gènes. Dans certains cas, ces réarrangements vont provoquer l’activation de gènes nommés « proto-oncogènes », qui peuvent entraîner la transformation des cellules et conduire à l’apparition de tumeurs.
Compartimentation et territorialisation du génome

Frédéric Bantignies, Giacomo Cavalli, Fourni par l’auteur
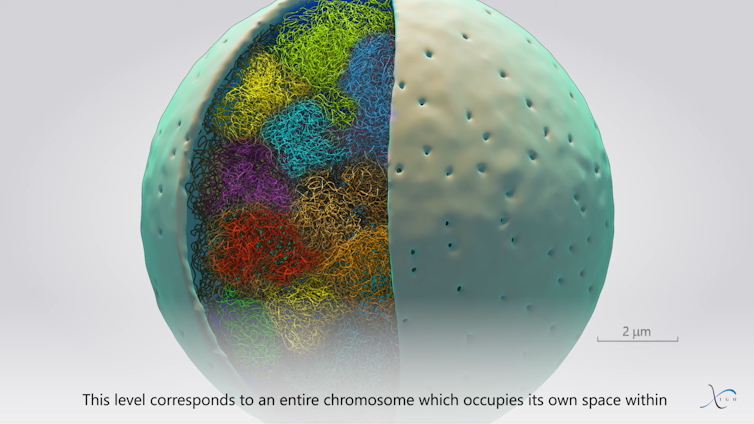
Plusieurs TADs vont ensuite se regrouper en deux compartiments distincts, le compartiment « A » qui contient principalement des gènes actifs et le compartiment « B », qui inclut principalement des gènes inactifs. Ce regroupement en compartiments permet de renforcer les fonctions du génome.
Frédéric Bantignies, Giacomo Cavalli, Fourni par l’auteur
Enfin, à l’extrémité de cette échelle d’organisation, on retrouve les territoires chromosomiques, qui permettent aux chromosomes d’être individualisés les uns par rapport aux autres au sein des noyaux. Cette organisation joue un rôle important lors de la réplication de l’ADN (copie à l’identique du matériel génétique) et de la division cellulaire, où chaque chromosome dupliqué est scindé en deux dans les cellules filles.
Et la boucle est bouclée ! Enfin presque : il s’agit désormais de mieux comprendre comment cette organisation influence les différents processus moléculaires inhérents au génome, qui régulent notamment l’expression des gènes, la réplication de la molécule d’ADN, sa réparation en cas de dommage ou de stress, ou encore sa recombinaison, notamment dans les cellules reproductrices. Le champ d’investigation reste immense, mais mieux connaître l’organisation du génome va ouvrir la voie à une meilleure compréhension de tous ces processus nucléaires dans les cellules normales, mais bien sûr aussi dans les cellules qui possèdent des défauts chromosomiques et qui conduisent à des maladies comme les cancers.![]()
Frédéric Bantignies, Directeur de Recherche CNRS, Université de Montpellier et Giacomo Cavalli, Directeur de recherche CNRS, Université de Montpellier
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.