Les mnemons : quand la mémoire passe par les protéines prions
De la même façon que nous sommes capables de mémoriser des informations, les organismes unicellulaires peuvent conserver la mémoire de leurs stress passés. Cela permet à ces cellules simples de mieux répondre à ce même stress dans le futur – et ainsi, par exemple, d’assurer la survie de la colonie.
Caudron Fabrice, Université de Montpellier
Mais comment se forment ces mémoires au niveau moléculaire ? Est-ce que ces mécanismes peuvent nous en apprendre plus sur les fondements même de la mémoire jusque chez l’être humain ? Voire nous aider à mieux comprendre les mécanismes de certaines maladies ?
Pour tenter d’en savoir plus, nous nous sommes intéressés à un processus de mémorisation présent chez la levure de boulanger, Saccharomyces cerevisiae. Voici les résultats de nos travaux, tout juste publiés dans la revue Current Biology.
Sexe et mémoire chez la levure de boulanger
Saccharomyces cerevisiae est un organisme assez simple : constitué d’une seule cellule possédant un noyau (comme les cellules humaines et à la différence des bactéries), il se reproduit de façon végétative, c’est-à-dire que sa cellule forme un bourgeon en surface qui deviendra la future cellule fille.
Toutefois, S. cerevisiae peut aussi se reproduire de façon sexuelle. Afin d’identifier un partenaire sexuel potentiel, les levures sécrètent et détectent des substances chimiques spécifiques : des phéromones sexuelles. Lorsque deux levures de type sexuel opposé se retrouvent à proximité, elles arrêtent leur reproduction végétative et font pousser une projection cytoplasmique (le cytoplasme étant le « corps » de la cellule, la partie qui entoure le noyau), que l’on nomme un « shmoo », vers leur consœur.
Les levures n’ayant pas la capacité de se mouvoir, elles s’allongent donc l’une vers l’autre jusqu’à se rencontrer et fusionner en un nouvel individu où vont se mélanger leurs génomes. Ce qui permet d’accroître leur diversité génétique.
Mais cet engagement dans la reproduction sexuelle est une décision coûteuse sinon risquée. Par exemple, on peut imaginer que deux cellules du même type sexuel fassent la cour à une seule cellule de type opposé. Une de ces deux cellules ne pourra pas fusionner avec sa partenaire présomptive et aurait donc produit un shmoo pour rien… Heureusement, les levures peuvent « choisir » de ne pas répondre à la phéromone – un refus qu’elles vont ensuite garder en mémoire pour longtemps.
En effet, une fois qu’une levure ne répond plus à la phéromone, c’est pour le reste de leur vie. Elle ne va alors plus se reproduire que de façon végétative. En revanche, ses futures cellules filles naîtront « naïves » : elles n’héritent pas de la mémoire de leur mère, et sont capables de réagir à toute phéromone sexuelle présente dans leur environnement.
Comment fonctionne la mémoire d’un organisme unicellulaire ?
La clef de la mémoire de S. cerevisiae est la protéine Whi3. En changeant de conformation (la façon dont elle se replie en trois dimensions), Whi3 devient inactive, ce qui permet à la cellule d’ignorer la phéromone.
Nous avons pu observer que cette protéine Whi3 se comporte un peu comme un prion – une protéine pathogène du fait de son repliement 3D anormal, et souvent contagieuse. Les protéines de type prion ont été mises en évidence dans les années 1980 par le neurologue américain Stanley Prusiner, notamment suite à la crise de la vache folle : il a démontré qu’en changeant de conformation tridimensionnelle, la protéine Prion devient pathogène et contagieuse, causant non seulement la pathologie chez les bovins, mais aussi la maladie de Creutzfeldt-Jakob au sein de notre espèce.
Pour en revenir à la levure, le changement de conformation de Whi3 est autoréplicatif, c’est-à-dire qu’il se transmet d’une protéine anormale à une protéine normale (qu’elle « contamine ») par simple contact, pour former des agrégats. Ce phénomène autoréplicatif pour encoder de la mémoire est intéressant, car il implique que la nouvelle conformation de sa protéine Whi3 peut s’inscrire dans le temps en se transmettant, et rester stable.
Toutefois, un problème de taille demeure : comment la cellule mère peut-elle s’assurer que « sa mémoire » ne va pas envahir sa cellule fille ?
Comprendre cette forme de mémoire physique
Il faut savoir que la levure abrite de nombreux types de protéines prions dont la plupart, une fois formés, sont transmis dans la cellule fille. Ce n’est toutefois pas le cas de Whi3, ce qui en fait son originalité.
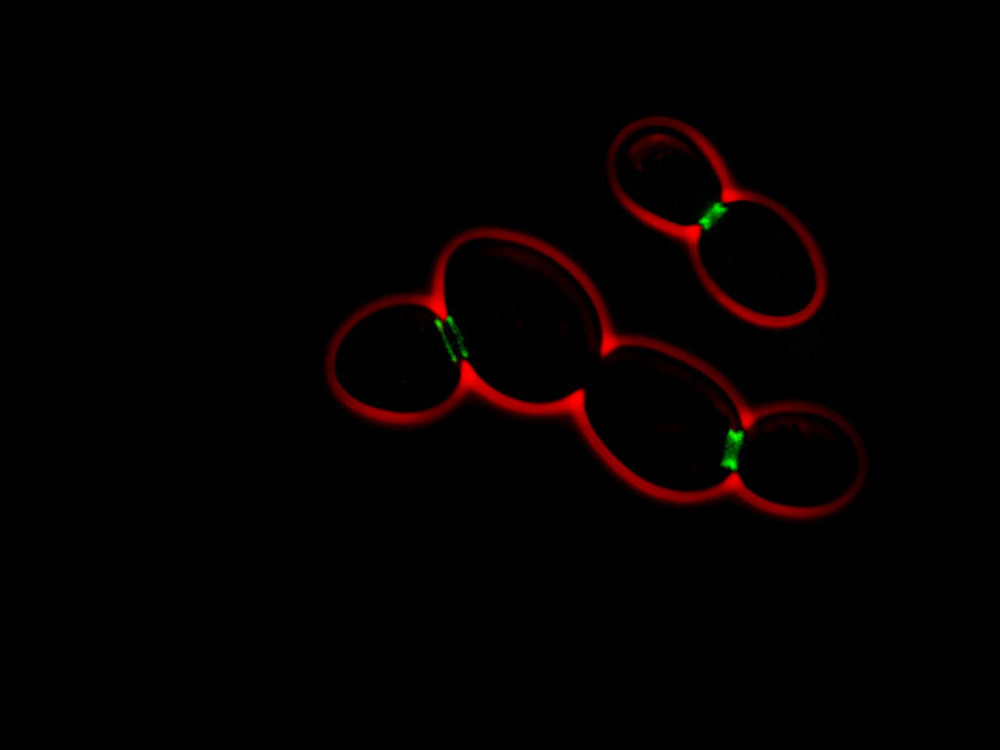
En utilisant la génétique de la levure et la microscopie, nous avons comparé le prion de levure le mieux compris, nommé Sup35 (le facteur de terminaison de la traduction), avec Whi3.
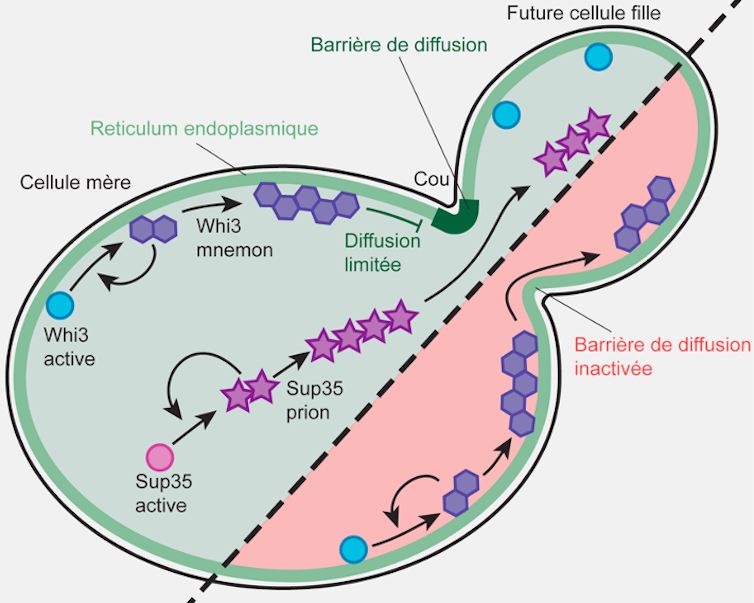
Nous avons déjà découvert que Whi3 s’associait aux membranes du réticulum endoplasmique (un immense sac en réseau où la cellule assemble ses protéines). Mais aussi que, dans ce réticulum, étaient mises en place des barrières entre la cellule mère et les éléments de sa future cellule fille – permettant ainsi la rétention des Whi3 de la génitrice.
La suppression génétique des barrières de diffusion entraîne la transformation des Whi3 en « vrai » prion, qui peuvent se propager dans les cellules filles. Le confinement de Whi3 et de la mémoire que cette protéine encode sont perdus. En revanche, la propagation du prion Sup35, qui ne se lie pas particulièrement au réticulum endoplasmique, n’est, elle, pas influencée par la barrière de diffusion.
Fabrice Caudron, Fourni par l’auteur
Un pas pour mieux comprendre les mémoires cellulaires
Cette étude met en lumière que l’association des protéines de type prions aux membranes, ainsi que la compartimentation de ces membranes par des barrières de diffusion, constitue ensemble un mécanisme puissant de formation de mémoires cellulaires épigénétiques (c’est-à-dire non liées à l’information codée dans l’ADN) à long terme. Ces « mémoires » peuvent être confinées dans un sous-compartiment de la cellule, ici la cellule mère en division.
La protéine Whi3, bien que très semblable à des prions, est donc considérée comme un « mnemon » : un type particulier de prion gardé sous contrôle et qui encode une mémoire. Mais, au final… quel est le rapport avec la mémoire neuronale, celle à l’œuvre dans notre cerveau ?
Il se trouve qu’une protéine importante pour la mémoire neuronale, par exemple pendant la mémorisation de déceptions sexuelles chez la mouche drosophile, dépend du comportement de type prion de la protéine CPEB dans la synapse, lieu de connexion entre deux neurones.
Nous formulons l’hypothèse que chez la drosophile, CPEB est aussi un mnemon, confiné dans la synapse activée lors de la formation de la mémoire. Ce confinement permettrait d’éviter que la protéine CPEB ne diffuse dans les synapses voisines du même neurone (ce qui risquerait de les activer de façon erratique et de compromettre la mémorisation).
Chez Homo sapiens, la protéine CPEB3 présente les mêmes caractéristiques que la CPEB de la drosophile : elle peut se comporter comme un prion, ou plus probablement, un mnemon. Ces similitudes impliquent que les bases de la mémoire, au niveau cellulaire, ont une longue histoire dans l’évolution…
Ces résultats et ces hypothèses posent la question de savoir si les maladies neurodégénératives associées à des prions et agrégats protéiques ne sont pas parfois dues à des défauts de confinement cellulaire. On sait, par exemple, que ces barrières sont moins efficaces dans les cellules souches de souris âgées. Serait-il alors envisageable d’essayer de les restaurer, afin de limiter la diffusion des protéines de type prion ?
Une piste encore théorique, mais qui ouvre de nombreuses perspectives…![]()
Caudron Fabrice, Chef d’équipe, biologie cellulaire, génétique de la levure, division cellulaire asymétrique, mémoire cellulaire, Université de Montpellier
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.