Et si le chromosome Y n’avait pas évolué comme prévu ?
C’est une des données de la génétique la plus connue : les femmes sont XX et les hommes XY. Chez les humains, les chromosomes déterminent le sexe, et cette paire particulière, la 23e, est la plus étonnante. C’est la seule paire de chromosomes où deux versions présentant d’énormes différences coexistent. Au point qu’il est même difficile de reconnaître dans cette paire deux chromosomes ancestralement très proches, mais qui, au fil de millions d’années d’évolution, sont devenus méconnaissables.
Thomas Lenormand, Université de Montpellier et Denis Roze, Sorbonne Université

Pourquoi les chromosomes sexuels ont-ils évolué pour devenir si singuliers ? Cette question taraude les généticiens depuis près d’un siècle. Plusieurs hypothèses ont été proposées au cours du temps, et une théorie s’est peu à peu consolidée. Pourtant, cette longue construction théorique vient d’être chamboulée par un nouveau modèle qui remet en cause cet édifice.
La dichotomie X-Y
NIH/Flickr, CC BY-NC
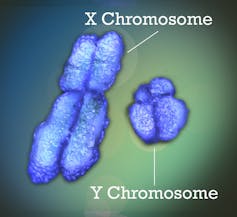
Le X est un chromosome assez banal, avec près de 800 gènes codant pour des protéines. Le Y, lui, est nettement plus étrange : plus petit (environ un tiers de la longueur du X), il ne lui reste environ qu’une soixantaine de gènes. Ces deux chromosomes forment toutefois bien une « paire ». Lors de la fabrication des spermatozoïdes, ils s’apparient et recombinent sur une petite portion (la recombinaison est un échange de matériel génétique, ici entre les deux chromosomes d’une même paire), témoignant de leur homologie ancestrale. Mais 95 % du Y ne recombine plus du tout. Le X, lui recombine sur toute sa longueur chez les femelles XX lors de la fabrication des ovules.
Enfin, autre bizarrerie, un seul X est exprimé chez les femelles. C’est-à-dire que les gènes sont lus pour donner des protéines à partir d’un seul X, soit celui hérité du père, soit celui hérité de la mère, aléatoirement selon les cellules. Cela permet une « compensation de dosage », afin que les gènes portés sur le X soient exprimés à un même niveau chez les mâles et les femelles.
Des différences largement répandues dans le vivant
On pourrait penser que ces excentricités sont propres à l’humain. Il n’en est rien : elles sont en fait extrêmement répandues chez les animaux, et même les plantes, même si les détails varient.
Mais, de manière très régulière, on observe un arrêt de recombinaison sur les chromosomes sexuels, un chromosome non-recombinant (Y) qui comporte peu de gènes fonctionnels (il est « dégénéré »), ainsi qu’une compensation de dosage.
Ces régularités sont vite tombées dans l’œil des généticiens, qui se sont mis à rechercher une théorie expliquant pourquoi la recombinaison s’arrête sur ces chromosomes, et pourquoi cet arrêt de recombinaison est associé à une dégénérescence. Ces mêmes généticiens se sont également vite rendu compte que répondre à cette question permettrait peut-être aussi de lever le voile sur une question générale qui les taraudait encore davantage : le rôle de la recombinaison dans l’évolution.
Le rôle de la recombinaison
La recombinaison, lors de la fabrication des gamètes, permet un « brassage » génétique. C’est une caractéristique essentielle de la reproduction sexuée, et sans doute le facteur clé expliquant l’avantage du sexe par rapport à la reproduction asexuée clonale. La dégénérescence des chromosomes sexuels non recombinants semble être une preuve grandeur nature de l’importance de la recombinaison pour maintenir l’intégrité des génomes, face au flux constant de mutations délétères altérant l’information génétique.
En effet, la plupart des chromosomes portent des mutations, qui peuvent être transmises d’une génération à l’autre lorsque leur effet sur la survie ou la fécondité des organismes n’est pas trop important. La version exempte de mutation d’un fragment de chromosome peut être assez rare au sein d’une population, et peut même disparaître si les individus la portant ne laissent pas de descendants. Lorsque cela arrive, un fragment exempt de mutation ne pourra être recréé que par recombinaison entre chromosomes portant des mutations à des endroits différents. Du fait de ce processus, on s’attend à ce que les zones non-recombinantes des chromosomes accumulent peu à peu des mutations.
L’absence de recombinaison pourrait donc expliquer la dégénérescence du Y. Mais cela ne résout pas entièrement la question : pourquoi diable les chromosomes sexuels s’arrêtent-ils de recombiner si cet arrêt mène à une dégénérescence ?
La théorie des gènes « sexe-antagonistes »
Jusqu’à nos travaux, cela était expliqué par la théorie des gènes « sexe-antagonistes ». Les mâles et les femelles diffèrent pour de nombreux caractères : c’est le dimorphisme sexuel. Pour de nombreux gènes, il y a donc des versions (des « allèles ») qui sont avantageuses pour un sexe et désavantageuses pour l’autre.

benjamint444/Wikimedia, CC BY-SA
Si ces gènes « sexe-antagonistes » sont fréquents, on peut s’attendre à en trouver sur les chromosomes sexuels. Supprimer la recombinaison (et donc l’échange d’allèles entre les chromosomes X et Y) peut alors devenir avantageux. Si un allèle avantageux chez les mâles se retrouve sur un Y qui ne recombine plus, il restera sur ce Y : il se trouvera toujours chez les mâles mais jamais chez les femelles.
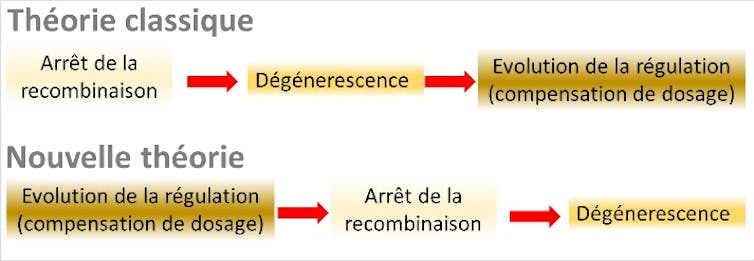
Une théorie globale de l’évolution des chromosomes sexuels en trois étapes s’est ainsi imposée. L’étape 1 est l’arrêt de recombinaison sur le Y, causé par la présence de gènes sexe-antagoniste sur les chromosomes sexuels. L’étape 2 est l’accumulation de mutations délétères (la dégénérescence), consécutive à l’arrêt de recombinaison. L’étape 3 est l’évolution de la compensation de dosage pour compenser le déficit d’expression des gènes du X chez les mâles.
Cette théorie avait l’avantage d’être très élégante, car très générale. Pourtant, plusieurs observations ultérieures ont remis peu à peu en cause cet édifice, et ont réouvert le débat théorique.
Une nouvelle théorie
Pour cela, nous sommes partis des seuls « ingrédients » qui paraissent indispensables pour expliquer l’évolution des chromosomes sexuels : des évènements d’arrêt de recombinaison sur le Y (mais qui ne sont pas irréversibles), des mutations délétères (la dégénérescence ne peut avoir lieu sans elles), et des régulateurs de l’expression des gènes qui peuvent moduler leurs niveaux d’expressions (la compensation de dosage ne peut avoir lieu sans eux).
À notre grande surprise, ces ingrédients, et notamment le dernier qui n’avait jamais été formellement intégré dans la théorie classique, se sont avérés suffisants. Notre recherche a mis au jour un processus global entièrement différent de la théorie « classique », où l’ensemble des relations de causalité est inversé, et les gènes « sexe-antagonistes » deviennent inutiles.
Thomas Lenormand, Fourni par l’auteur
Comme la théorie classique, cette nouvelle théorie suppose une situation ancestrale dans laquelle un gène porté par une paire de chromosomes « normaux » (des autosomes) détermine le sexe des individus. Deux formes différentes de ce gène (ou allèles, qu’on notera M et F) coexistent, les individus MF se développant en mâles et les individus FF en femelles.
On suppose ensuite que des inversions chromosomiques peuvent se produire : une inversion correspond à un « retournement » d’une partie du chromosome, les gènes situés dans cette partie se retrouvant alors dans un ordre inversé. Ces inversions correspondent à une forme de mutation assez rare, mais se produisant néanmoins de temps en temps au sein des populations. Elles ont pour effet d’empêcher (au niveau de l’inversion) la recombinaison entre chromosomes inversés et non-inversés. En effet, l’ordre différent des gènes empêche l’appariement correct des chromosomes dans cette zone.
Lorsqu’une inversion englobant l’allèle M (déterminant le sexe mâle) se produit, celle-ci peut être avantagée si les gènes qu’elle contient portent moins de mutations délétères que la moyenne. Dans ce cas, elle va augmenter en fréquence au cours des générations, jusqu’à ce que tous les individus mâles portent cette inversion. De ce fait, les chromosomes portant les allèles F et M deviennent des « proto-chromosomes » X et Y, ne recombinant plus sur une partie de leur longueur (dans la zone de l’inversion).
Cependant, l’arrêt de la recombinaison cause, à terme, une accumulation de mutations délétères sur le chromosome portant l’allèle M (celui portant l’allèle F continuant à recombiner chez les femelles). Cette accumulation de mutations peut favoriser soit un retour à la recombinaison (par exemple, par une nouvelle inversion chromosomique restaurant l’ordre initial des gènes), soit une réduction de l’expression des gènes mutés portés par le proto-Y, qui sera compensée par une augmentation de l’expression des gènes du proto-X : c’est le début de la compensation de dosage. Lorsque celle-ci se met en place suffisamment vite, elle empêche tout retour en arrière : une restauration de la recombinaison aura pour effet de détruire cet équilibre délicat entre les niveaux d’expression des gènes du X et du Y.
Les simulations informatiques que nous avons réalisées montrent ainsi un arrêt progressif de la recombinaison, par « strates » successives correspondant à différentes inversions stabilisées par l’évolution de la compensation de dosage, sans qu’il y ait besoin d’invoquer l’existence de gènes à effet sexe-antagoniste.
En renouvelant entièrement notre vision des scénarios possibles d’évolution des chromosomes sexuels, cette nouvelle théorie ouvre un vaste champ d’expérimentations et de tests empiriques. Elle montre également l’importance de prendre en compte les mécanismes de régulation de l’expression des gènes dans la théorie de l’évolution. Finalement, elle pourrait suggérer que prendre en compte l’évolution des régulateurs pourrait être une des clés pour résoudre le mystère du maintien de la reproduction sexuée chez les plantes et les animaux.![]()
Thomas Lenormand, Research director, Université de Montpellier et Denis Roze, Chercheur en génétique évolutive, Sorbonne Université
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.